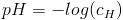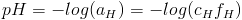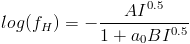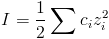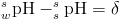Pierwsza historycznie definicja pH miała postać:
gdzie:
- cH – stężenie jonów wodorowych (mol/L)
Ponieważ występowała niezgodność pomiędzy pH obliczonym i oznaczanym metodami instrumentalnymi, definicja została zmodyfikowana do postaci:
gdzie:
- aH – aktywność jonów wodorowych,
- fH – współczynnik aktywności.
Wartość aH wyraża odstępstwa od stanu standardowego dla jonu H, czyli od stanu nieskończonego rozcieńczenia tego jonu w roztworze. Wobec tego można zapisać, że aH -> cH i fH -> 1, gdy cH -> 0. Oznacza to, że dla roztworów rozcieńczonych aktywność jonów wodorowych jest w przybliżeniu równa ich stężeniu, czyli wartość współczynnika fH wynosi 1. W roztworach stężonych współczynnik aktywności ma wartość mniejszą od jedności, czyli aktywność jonu wodorowego jest mniejsza niż jego stężenie. Powyższa definicja pH jest dobra z pojęciowego punktu widzenia. Z praktycznego punktu widzenia jest jednak trudna do stosowania, gdyż zawiera niemierzalną wartość, jaką jest aktywność pojedynczego jonu aH. Żeby uzyskać wartość pH potrzebna jest zależność, która pozwalałaby na przybliżenie współczynnika aktywności. Wykorzystuje się zazwyczaj zależność Debye’a-Hückela:
gdzie:
- A,B – stałe zależne od rodzaju rozpuszczalnika i temperatury,
- ao – stała będąca funkcją średnicy uwodnionego jonu,
- z – ładunek jonu,
- I – siła jonowa roztworu:
Pomiar pH w mieszaninach wodno-organicznych możliwy jest na trzy różne sposoby. W przypadku pomiaru pH za pomocą pehametru, stan standardowy zależy od rodzaju buforów użytych do kalibracji. Z tego powodu, według IUPAC w układzie woda – modyfikator organiczny mogą być wyróżnione trzy skale pH, ze względu na sposób pomiaru i kalibracji urządzenia pomiarowego:
- skala wwpH – pomiar pH wykonywany jest przed dodatkiem modyfikatora organicznego; bufory standardowe nie zawierają modyfikatora organicznego
- skala wspH – pomiar pH wykonywany jest po dodaniu modyfikatora organicznego; bufory standardowe nie zawierają modyfikatora organicznego
- skala sspH – pomiar pH wykonywany jest po dodaniu modyfikatora organicznego; bufory standardowe zawierają taką samą ilość danego modyfikatora organicznego, jak roztwór badany.
Według tej notacji umieszczony po lewej stronie symbolu pH indeks górny określa rozpuszczalnik, w którym dokonywane są pomiary. Natomiast indeks dolny po lewej stronie określa rozpuszczalnik użyty do kalibracji układu pomiarowego. Symbol w oznacza wodę.
W praktyce laboratoryjnej ze względu na łatwość kalibracji używane są skale swpH oraz wwpH. Ta ostatnia nie daje informacji o rzeczywistym pH, w przypadku rozcieńczenia buforu modyfikatorem organicznym.
Z powyższej definicji pH wynika, że trzy stosowane procedury pomiaru prowadzą do różnych wartości pH, jednakże zależność pomiędzy sspH i wspH jest stała dla każdej mieszaniny wody i modyfikatora organicznego:
Przykładowo δ dla mieszaniny woda – metanol może być oszacowana na podstawie równania:
Znajomość parametru δ dla mieszanin woda – modyfikator organiczny jest bardzo przydatna, gdyż pozwala na kalibrację pehametru przy pomocny wodnych roztworów buforowych i zmierzenie wartości wspH która (poprzez wartość δ) może być przekształcona do sspH. Wartość ta jest wielkością, która może być bezpośrednio odnoszona termodynamicznie do stałej kwasowości, a także do stężenia roztworu poprzez współczynnik aktywności, wyznaczony z równania Debye’a-Hückela. Niestety, wartości δ są dostępne tylko dla niektórych modyfikatorów organicznych (metanol i acetonitryl). Z kolei, różnica pomiędzy sspH a wwpH nie jest wielkością stałą. Zależy ona nie tylko od składu ilościowego fazy ruchomej, ale również od rodzaju buforu. Jest tak dlatego, że dodatek modyfikatora organicznego powoduje zmiany pH związane z rozcieńczeniem, ze zmianą wartości pKa kwasów lub zasad tworzących bufor oraz ze zmianą wartości pKap, czyli stałej autoprotolizy mieszaniny.
Literatura:- R. Kocjan, Chemia analityczna Podręcznik dla studentów 1, PZWL, Warszawa 2002, wyd. II
- Z.S. Szmal, T. Lipiec, Chemia analityczna z elementami analizy instrumentalnej, PZWL, Warszawa 1996, wyd. VII.
- M. Roses, E. Bosch, J. Chrom. A, 982 (2002) 1-30
- E. Bosch , P. Bou, H. Allemann, M. Rosés, Anal. Chem. 68 (1996) 3651
- B. Modrzejewski, Pomiary pH, WNT, Warszawa, 1971